Chemie - Vazby atomu
Chemická vazba
Atom vodíku má v obalu 1 nepárový elektron. To je pro něj nevýhodné, protože nemá zcela zaplněnou vnější vrstvu elektronů.
Atom vodíku se může spojit s jiným atomem vodíku. Atomy se k sobě přiblíží tak, aby se překryly jejich elektronové obaly. Elektrony vytvoří dvojici (elektronový pár). Tomuto páru říkáme chemická vazba.
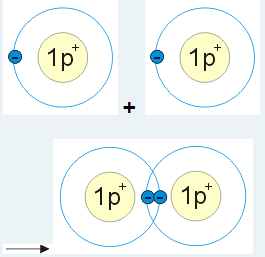
Chemická vazba je tvořena dvojicí (párem) elektronů. Tomuto páru říkáme vazebný elektronový pár. Na vzniku chemické vazby se podílejí pouze elektrony ve vnější vrstvě.
Chemické vazbě, která je tvořena jedním párem elektronů říkáme vazba jednoduchá. Znázorňuje se jednou čárkou mezi značkami prvků, např. H - H.
Některé atomy mohou tvořit více než jednu vazbu. Atom kyslíku má ve vnější vrstvě 6 elektronů, z toho 2 jsou nepárové. Každý z těchto dvou elektronů může vytvořit chemickou vazbu. Ŕíkáme, že atom kyslíku je dvojvazný (může vytvořit 2 vazby).
Atom kyslíku se může spojovat s jiným atomem kyslíku. Oba atomy sdílejí dva elektronové páry. Vytvořila se mezi nimi vazba dvojná.
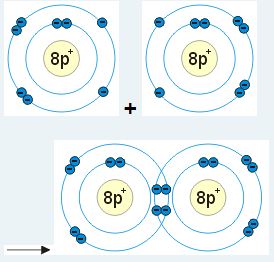
Dvojná vazba je tvořena dvěma vazebnými páry elektronů. Znázorňuje se dvěma čárkami mezi značkami atomů, např. O = O.
Atom kyslíku může také kromě jedné dvojné vazby vytvořit dvě vazby jednoduché, např. v molekule vody.
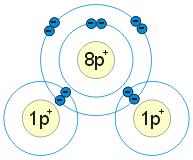
Množství vazeb, které může atom s jinými atomy vytvořit, se nazývá vaznost.
Prohlédni si atom dusíku. Kolik vazeb může vytvořit s jinými atomy?
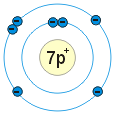
Atom dusíku má 3 nepárové elektrony. Může tedy vytvořit 3 vazby s jinými atomy. Mohou to být:
- tři vazby jednoduché - např. v molekule amoniaku
- jedna vazba dvojná a jedna jednoduchá
- jedna vazba trojná. Trojná vazba je např. v molekule dusíku N2.
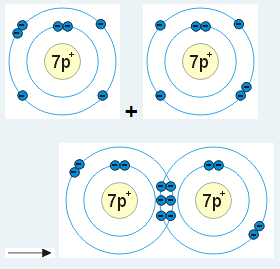
Trojná vazba je tvořena třemi vazebnými páry elektronů. Znázorňuje se třemi čárkami mezi značkami atomů, např. N ≡ N
Iontová a kovalentní vazba
Zde se můžeš podívat na animaci těchto vazeb a zároveň si procvičit angličtinu ;)